Methoden der Kohlenstoffmessung im Gelände und im Labor
1.2 Gelöster organischer Kohlenstoff (DOC)
verfasst von Mayte Schwalm
Inhalt dieses Kapitels
1. Definition von
DOC
1.1 Funktionen von DOC in Ökosystemen
1.3 Problematik
von DOC
2.1 DOC in Mooren
2.2
Kohlenstoffverluste durch DOC
3. Wirkung von Umwelt- und Standortfaktoren auf DOC-Gehalte und
-Austräge
3.1 Einflüsse abiotischer Standortparameter
3.2 Wirkung
von Landnutzung
3.3 Entwässerung und Wiedervernässung von Mooren
3.4 Düngung und
Kalkung
3.5
Pflanzenschutzmittel und Bodenbearbeitung
4. Fazit
1. Definition von DOC
Als DOC (dissolved organic carbon) werden generell alle organischen Kohlenstoffverbindungen angesprochen, welche einen Filter mit 0,45 µm Porenweite passieren (Thurman 1985). Das Spektrum der als DOC bezeichneten Substanzen ist groß; beispielhaft seien Huminstoffe, organische Säuren, Saccharide oder Aminosäuren genannt. Diese Produkte werden im Boden durch Pflanzen ausgeschieden oder entstehen im Verlauf der Zersetzung organischer Substanz durch mikrobielle Aktivität sowie abiotische Prozesse.
Im Wasser gelöster organischer Kohlenstoff (DOC)
 (Foto: Mayte Schwalm 2010) |
1.1 Funktionen von DOC in Ökosystemen
DOC ist ein
natürlicher Bestandteil der Bodenlösung und an vielen bedeutsamen
Prozessen beteiligt. DOC ist ein wesentliches Nährstoffsubstrat für
Mikroben (Marschner und
Bredow 2002) und steuert Habitateigenschaften, wie die
Azidität oder Temperaturschichtung in Gewässern (Gorham et al. 1986, Fee
et al. 1996). Des Weiteren ist DOC an Bodenbildungsprozessen
beteiligt, bspw. durch Forcierung der mineralischen Verwitterung oder im
Zusammenhang mit der Podsolierung (Dawson
Et al. 1978). In Abwesenheit von Sauerstoff (besonders relevant
auf Moorstandorten) fungieren DOC-Moleküle als Elektronendonator und
ermöglichen somit mikrobielle Metabolismen, wie z.B. die Denitrifikation
(Chapelle 2000). Als
Bindungspartner von Metallen und Schadstoffen beeinflusst gelöste
organische Bodensubstanz (DOM) die Mobilität und den Transport dieser
Stoffe (Driscoll et al.
1988, Helmer et al. 1990,
Chin et al. 1998).
1.2 Entstehung und Abbau von
DOC
Die besondere Bedeutung von Bodenmikroben besteht nicht nur im Abbau von organischer Substanz, sondern auch darin, dass die Mikroben selbst nach dem Absterben ein leicht verwertbares Nährsubstrat darstellen. Die wesentlichen Prozesse zur Entstehung von DOC sind unter anaeroben Bedingungen die Fermentation (Aravena und Wassenaar 1993) sowie in aeroben Bodenzonen die Oxidation von organischer Substanz (Palmer et al. 2001). Der Abbau von mobilem DOC erfolgt im aeroben Bereich durch mikrobielle Respiration unter Bildung von CO2. Unter anaeroben Bedingungen kann DOC bei der Sulfat- und Nitratreduktion zur CO2-Bildung bzw. im Rahmen der Methanogenese zur CH4-Produktion beitragen (Mitch und Gosselink 2000). DOC-Bestandteile werden unterschiedlich schnell abgebaut und können in die zwei Fraktionen labil und rekalzitrant unterteilt werden. Die Abgrenzung dieser Gruppen erfolgt in der Literatur recht unterschiedlich (z.B. bei Søndergaard und Middelboe 1995 sowie Tranvik 1998), wobei labiles DOC als kurzfristig für Mikroben nutzbar gilt (Stunden oder Tage), während rekalzitrante Substanzen deutlich länger bestehen (> Jahre).
Entstehung und Abbau von DOC
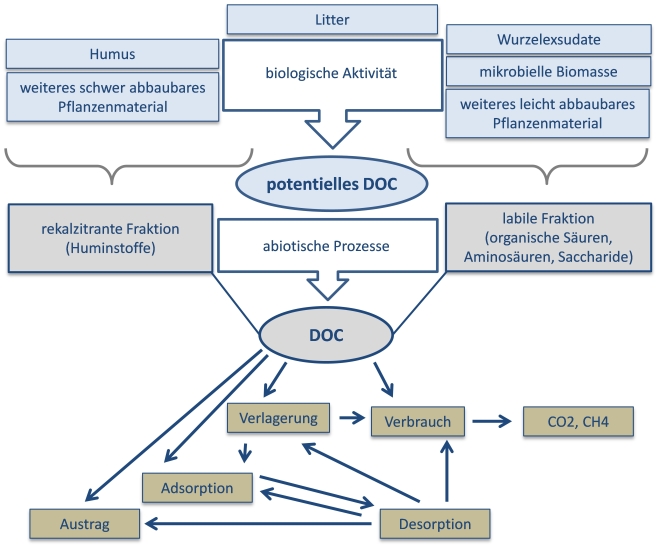 (Quelle: Schwalm 2010) |
1.3 Problematik von DOC
DOC erfüllt also vielerlei Funktionen in aquatischen und semiterrestrischen Ökosystemen. Die übermäßige Anreicherung von DOC in Grund- oder Oberflächenwässern ist jedoch als problematisch anzusehen. Zunächst ist der DOC-Austrag aus Böden in Gewässer mit einer erheblichen Minderung der Wasserqualität verbunden: Die Aufbereitung zu Trinkwasser wird technologisch erschwert, bei Chlorierung des Wassers ist die Bildung karzinogener Substanzen möglich (Krasner 1999, Chow et al. 2003), zudem führt DOC zu einer farblichen und olfaktorischen Beeinträchtigung des Wassers. Darüber hinaus stellt die Prozesskette von Bildung, Austrag und mikrobiellem Abbau von DOC einen Verlust des im Boden gespeicherten Kohlenstoffs (C) dar, zumal der Abbau von DOC mit der Emission von CO2 und CH4 verbunden sein kann. Da die Freisetzung von C aus dem System Boden wesentlich rascher vonstattengeht als die vorangegangene Akkumulation, muss der C-Verlust durch Austrag gelöster organischer Verbindungen als kaum reversibel eingeschätzt werden.
2.1 DOC in Mooren
Von besonderer Relevanz ist DOC in Mooren, denn diese speichern in der organischen Bodensubstanz (OBS) bis zu 2.000 t C ha-1 (Zeitz et al. 2008) und somit erhebliche Vorkommen an potenziellem DOC (zu DOC abbaubare Produkte). Aus diesem Grund und wegen des geringen DOC-Adsorptionsvermögens (Ursache ist der relativ geringe Tongehalt verglichen mit mineralischen Böden), zeigen organische Böden bis zu 25-fach höhere DOC-Verluste als mineralische Standorte (Moore 1998). Die Mineralisierung von DOC in hydromorphen Böden verläuft verglichen mit Mineralböden hingegen relativ langsam ab, da anaerobe Verhältnisse herrschen und wenig labiles, leicht abbaubares DOC vorhanden ist (Kalbitz et al. 2003).
Film zur DOC-Messung auf Niedermoorflächen bei Paulinenaue, Brandenburg
Manueller Download des Videos (Quelle: Thelemann 2012)
Die DOC-Zusammensetzung variiert sowohl auf der zeitlichen als auch auf der räumlichen Ebene (Sachse et al. 2001, 2005), was in Kombination mit der Vielzahl der unter dem Begriff DOC zusammengefassten Substanzen dazu führt, dass sich die Wirkung abiotischer und biotischer Einflussgrößen nur schwer nachweisen lässt. Speziell für Niedermoore in Brandenburg (Zak et al. 2004) und generell für Feuchtgebiete i.w.S. (Thurman 1985) sind Huminstoffe mit einem Anteil von bis zu 90 % als Hauptkomponente von DOC nachgewiesen worden. Diese sind auch für die bräunliche Färbung von Moorwasser verantwortlich. Typische DOC-Konzentrationen im Bodenwasser von Mooren liegen zwischen 20 und 100 mg l-1, es sind jedoch auch weitaus höhere Werte von > 200 mg l-1 erfasst worden.
2.2 Kohlenstoffverluste
durch DOC
Die C-Austräge aus Mooren werden häufig maßgeblich durch DOC bestimmt. Dawson et al. (2002, 2004) zeigten, dass die DOC-Verluste aus Mooren in die Hydrosphäre zwischen knapp 70 % und über 90 % der gesamten C-Verluste ausmachten. Eigene Ergebnisse (Schwalm 2010) und Literatur von Kieckbusch (2003) bestätigen dies, indem der Gesamtaustrag des organischen C durch lediglich < 3 % bzw. < 16 % über POC (partikulärer organischer Kohlenstoff) erfolgte. Des Weiteren sind in Inkubationsversuchen von Moore und Dalva (2001) vom totalen C-Verlust (als DOC+CO2+CH4) durchschnittlich 85 % durch DOC ausgetragen worden. Anders als in den vorangegangenen Arbeiten zeigten Fiedler et al. (2008) für Niedermoore in Süddeutschland, dass Austräge von Kohlenstoff über POC oder DIC (gelöster anorganischer C) bisweilen die Größenordnung von DOC-Verlusten erreichen oder sogar übersteigen können.
Die absolute Menge der C-Verluste durch DOC hängt von der DOC-Konzentration im Wasser und dem Abfluss ab. Diese zwei Parameter sind äußerst dynamisch und die Austräge variieren entsprechend stark. Die beobachteten Austräge schwanken zwischen 1 und 50 g C m-2 a-1, wobei das Gros der Werte unter 10 g C m-2 a-1 (= 100 kg C ha-1 a-1) liegt. Diese Zahlen zeigen, dass die C-Verluste durch DOC durchaus erheblich sind und eine C-Bilanz ohne Berücksichtigung von DOC mit beträchtlichen Fehlern verbunden ist.
3. Wirkung von Umwelt- und Standortfaktoren auf DOC-Gehalte und
-Austräge
3.1 Einflüsse abiotischer Standortparameter
Die Wirkung des pH-Wertes auf DOC-Gehalte wird inkonsistent beschrieben (Kalbitz et al. 2000). Vermutlich überlagern sich Ad- und Desorptionsprozesse mit weiteren Wechselwirkungen, da der pH nicht nur direkt auf die Kationenaustauschkapazität (KAKeff) und somit die DOC-Adsorption wirkt, sondern auch indirekt über bspw. die Beeinflussung des Edaphons. Auch konnten ex-situ erzielte Ergebnisse im Freiland – aufgrund der Komplexität und der längeren Betrachtungszeiträume – häufig nicht bestätigt werden (ebd., Michalzik und Matzner 1999). In Laborversuchen mit mineralischen und/oder organischen Bodenhorizonten werden zumeist positive Korrelationen von pH und DOC-Freisetzung beschrieben (Hay et al. 1985, Vance und David 1989, Jòzefaciuk et al. 1996, You et al. 1999, Kalbitz et al. 2000), was plausibel erscheint, da bei steigendem pH eine Erhöhung der Mikrobenaktivität und damit eine stärkere Zersetzung von OBS zu DOC zu erwarten ist (Curtin et al. 1998, Moore 1998). Steigende pH-Werte infolge basischer Immissionen auf organischen Böden haben in Untersuchungen von Kalbitz und Knappe (1997) allerdings zu sinkenden Austrägen von gelöster organischer Substanz (DOM) geführt, da erhöhte Bakterienaktivität einen schnellen Umsatz von DOM zur Folge hatte. Niedrige pH-Werte schränken die Bodenmikroben in ihrer Aktivität ein, können allerdings auch dazu führen, dass DOC schlecht löslich ist (Evans et al. 2006) und eher geringe Austräge die Folge sind. Die in den letzten 20 Jahren z.B. in Großbritannien beobachteten Anstiege der DOC-Austräge sind daher möglicherweise auf den Anstieg des pH-Wertes nach dem Rückgang der Schwefeldepositionen aus Industrieanlagen zurückzuführen (ebd.).
Bei optimaler Temperatur und Feuchtigkeit im Boden werden Destruenten befördert, weshalb eine stärkere DOC-Produktion auftreten kann. So ist in Inkubationsversuchen (sowohl mit mineralischen Böden als auch mit Moorsubstraten) bereits eine enge, positive Korrelation zwischen Temperatur und der DOC-Produktion beobachtet worden (Christ und David 1996, Clark et al. 2009). Andere Ergebnisse aus Inkubationsversuchen von Chow et al. (2006) weisen einen derartigen Zusammenhang nicht auf, was womöglich daran liegt, dass die verwendeten Temperaturstufen bei einer geringen Bodenfeuchte (0,3 g H2O g Boden-1) der Torfe getestet wurden: Die Wirkung der Temperatur trat in den Hintergrund, da Wasser der limitierende Faktor war. Die Zusammensetzung und Höhe der DOC-Konzentration zeigt sich als deutlich von der Bodenfeuchte beeinflusst. Da Bakterien auf ein wässriges Milieu angewiesen sind, steigt mit zunehmender Bodenfeuchte deren Aktivität in Humushorizonten, weshalb es zu einer Steigerung in der Produktion von DOC kommt (Falkengren-Grerup und Tyler 1993, Christ und David 1996). Je feuchter das Milieu, desto größer wird der Anteil hydrophober Säuren (Christ und David 1996, Chow et al. 2006).
Zusammenfassend lässt sich sagen, dass sowohl pH, als auch Temperatur und Wasserdargebot die Höhe der DOC-Konzentration beeinflussen, wie insbesondere in ex situ Versuchen belegt werden konnte. Dies beruht im Wesentlichen darauf, dass durch günstige ökologische Bedingungen die Mikrobenaktivität im Boden gesteigert wird und infolgedessen eine beschleunigte Zersetzung der OBS mit entsprechender Nachlieferung von DOC erfolgt. Im Freiland sind die Effekte der genannten Faktoren nicht oder widersprüchlich nachgewiesen worden. Dies ist womöglich damit zu erklären, dass die Optimierung eines Ökofaktors nur dann eine Wirkung auf die Bodenbakterien zeigt, wenn kein anderer Faktor im Minimum ist und limitierend wirkt. Der Umweltfaktor Wasser ist dabei nicht nur mikrobiologisch bedeutsam, sondern stellt auch das Transportmedium für DOC dar; bei Starkregenereignissen wird also einerseits das mikrobielle Edaphon aktiviert und andererseits werden Stofffrachten stärker bewegt (Arvola et al. 2004, Hagedorn et al. 2000). Ein zweiter Aspekt, der zu widersprüchlichen Untersuchungsergebnissen führt, ist die Tatsache, dass durch erhöhte Mikrobentätigkeit zwar mehr DOC entsteht, aber gleichzeitig auch größere Mengen durch Bakterien metabolisiert werden (Chow et al. 2006).
In Bezug auf die Diskussion um mögliche Klimaänderungen und deren Auswirkungen auf die Stoffverluste aus Mooren rechnen Freeman et al. (2001, 2004) mit steigenden DOC-Austrägen, da erhöhte CO2-Gehalte der Atmosphäre und steigende Temperaturen die Mikrobenaktivität im Boden erhöhen können und folglich größere DOC-Verluste zu erwarten sind.
3.2 Wirkung von Landnutzung
Um den Einfluss der Landnutzung auf DOC-Verluste von Mooren zu diskutieren, ist es zunächst nötig, mögliche, durch Nutzung entstandene Veränderungen der Standorteigenschaften zu benennen. Die landwirtschaftliche Innutzungnahme hydromorpher Böden setzt in den meisten Fällen eine Entwässerung der Flächen voraus. So sind im Nordosten Deutschlands zwischen 90 % und 95 % der Niedermoore durch Entwässerung – beginnend im 17. Jahrhundert, aber insbesondere in den letzten 60 Jahren – in ihrem Wasserhaushalt erheblich gestört. Die mit der Belüftung der oberen Bodenzone einsetzende Mineralisierung des Torfes führt zu Stoffverlusten und einer relativen Anreicherung mit Nährstoffen. Zunehmende Bemühungen zur Revitalisierung von Mooren ergeben einen gegenläufigen Trend, indem entwässerte Landwirtschaftsflächen wiedervernässt oder zumindest höhere Wasserstände eingestellt werden. Weitere, mit Landnutzung einhergehende Maßnahmen sind Düngung, Kalkung, Pflanzenschutzmaßnahmen sowie Bodenbearbeitung. Während Düngungsstrategien auf den Nährstoffhaushalt des Bodens wirken, stellt die Kalkung eine Möglichkeit der Regulation eines ökologischen Faktors (pH) für Edaphon/Vegetation dar. Pflanzenschutzmittel könnten sich auf bodenbewohnende Fauna auswirken und eine mögliche Bodenbearbeitung wirkt vor allem durch eine veränderte Belüftung des Oberbodens (verfestigen versus lockern) auf DOC.
Allgemein kann eine starke anthropogene Störung von Mooren zu erhöhten Stoffverlusten in Form von DOC-Austrägen führen. So sind nach Abtorfung (Glatzel et al. 2003) und auch nach Bau von Windparks (Grieve und Gilvear 2008) infolge der Entwässerung und Nutzung der Standorte steigende DOC-Austräge beobachtet worden. Langjährige und intensive Landbewirtschaftung verändert darüber hinaus die DOC-Qualität eines Standorts, indem bei Fulvinsäuren verstärkt aromatische Strukturen und Humifizierung beobachtet worden sind (Kalbitz et al. 1999).
3.3
Entwässerung und Wiedervernässung von Mooren
Die Veränderung der natürlichen hydrologischen Verhältnisse ist in Mooren der Eingriff mit den größten Auswirkungen. Nach Entwässerung belüftete Bodenschichten unterliegen einer starken Zersetzung und Mineralisierung der organischen Substanz. Als Zwischenprodukt könnte nun verstärkt DOC entstehen. Werden die Böden sehr trocken (bspw. im Sommer) dürfte allerdings die Mikrobenaktivität zurückgehen und der biologische Abbau von OBS sowie der Verbrauch von DOC stagnieren. Insgesamt kommt es in dieser Phase zu einer Akkumulation von DOC im Boden, was sich jedoch aufgrund des geringen Wasservorrats sowie der kurzen Passagezeit des Wassers nicht in hohen Austrägen widerspiegelt (Böhm 2006, Schwalm 2011). Kommt es nach einer trockenen Periode zu einem Wiederanstieg der Bodenfeuchte (z. B. Starkregenereignisse oder Wiedervernässung), treten erhöhte DOC-Austräge auf (Lundquist et al. 1999, Tipping et al. 1999, Merckx et al. 2001, Chow et al. 2003). Ursache dafür ist, neben der genannten Akkumulation von DOC, der Umstand, dass nun erhöhte Gehalte redox-sensitiver Substanzen vorhanden sind, die zu einer Mobilisierung von festgelegtem DOC führen (Zak und Gelbrecht 2007). Nach erfolgter Wiedervernässung kann zudem die Biomasse abgestorbener Mikroben dem DOC-Pool zugeführt werden; zusätzlich ist eine leichtere Zersetzbarkeit vormals stabiler organischer Verbindungen infolge der Störung der Bodenstruktur denkbar (ebd.). Je stärker der Torf während der Entwässerungsperiode degradiert worden ist, desto größer ist die anschließende Mobilisierung des organischen Kohlenstoffs (Zak und Gelbrecht 2007), so dass degradierende Landnutzung als Aktivator für hohe DOC-Austräge angesehen werden kann (Abb. 2).
Auf vielen intensiv genutzten Niedermooren ist mit periodischen Wasserstandschwankungen zu rechnen, wodurch erhöhte DOC-Austräge aufgrund der oben genannten Ursachen angenommen werden müssen. Die erhöhten Stoffausträge nach einer Wiedervernässung sinken mit der Zeit. Renaturierte Niedermoore mit dauerhaft oberflächennahen Grundwasserständen können langfristig wieder ihre Retentionsfunktion wahrnehmen. Nach einigen Jahrzehnten sinken die DOC-Austräge unter das Niveau entwässerter Niedermoore und diese fungieren wieder als C-Speicher (Höll 2007, Höll et al. 2009), zeigen jedoch höhere Austräge als naturnahe Standorte (Zak et al. 2004).
3.4 Düngung und Kalkung
Der Effekt von Düngung
besteht darin, dass sich mit steigenden Gehalten von organischer
Bodensubstanz (OBS) die Menge des potenziellen DOCs erhöht, weshalb
Produktion und Austrag von DOC verstärkt werden können (Moore 1998).
Alle Formen der organischen Düngung (Ausbringen von Stallmist oder
Gülle, Gründüngung, Unterpflügen der Stoppel) führen demzufolge zu einer
erhöhten Nachlieferung von DOC. Beim Vergleich von organischer mit
mineralischer Düngung auf Mineralböden zeigten sich deutlich höhere
DOC-Gehalte nach der Applikation von organischer Düngung (Lundquist
et al. 1999). Durch Einsatz synthetischen Stickstoff-Düngers kann zum einen
der pH, zum anderen die Trophie im Boden verändert werden, wodurch
wiederum der DOC-Gehalt im Boden verändert werden könnte. Die
Beeinflussung des pH-Wertes und der DOC-Konzentration im Boden durch
verschiedene N-Düngung untersuchten Evans et
al. (Review 2008) für
mineralische Standorte: Während Düngung mit Natronsalpeter die
DOC-Konzentration erhöhte, konnte nach Zugabe von Ammoniumsalzen eine
Abnahme von DOC beobachtet werden. Für Hochmoore zeigten
Bragazza et al.
(2006), dass durch steigende Einträge von atmosphärischem N die
Zersetzung der organischen Substanz im Torf beschleunigt wird, weshalb
es in der Folge zu erhöhten DOC-Austrägen und CO2 Emissionen kam.
Durch Ausbringen von Kalk wird der pH-Wert im Boden angehoben, was die
Umweltbedingungen für Bodenmikroben verbessert. Die folgende
Aktivitätssteigerung kann sich einerseits durch erhöhte
DOC-Konzentrationen infolge der stärkeren Zersetzung von OBS zeigen,
andererseits kann DOC auch entsprechend zügig verbraucht werden, so dass
erhöhte Austräge nicht zwingend auftreten.
3.5
Pflanzenschutzmittel und
Bodenbearbeitung
Schadstoffeinträge,
welche Bodenlebewesen hemmen, können eine Akkumulation von gelöster
organischer Substanz in mineralischen Böden zur Folge haben (Kalbitz
und Knappe 1997) und das Risiko hoher Austräge bergen. Der Einsatz von
Pflanzenschutzmitteln auf Moorstandorten könnte demnach durch eine
Beeinflussung der pedogenen Mikrobenpopulationen die DOC-Dynamik
beeinflussen – diesbezügliche Untersuchungen existieren nach Wissen der
Autoren jedoch nicht. Bekannt ist hingegen, dass DOC
Pflanzenschutzmittel und andere Schadstoffe sowie Schwermetalle im Boden
mobilisiert und transportiert (Baskaran et
al. 1996, Driscoll et al. 1995,
Kalbitz und Wenrich 1998), weshalb es zum Austrag unerwünschter
Substanzen in die Hydrosphäre kommen kann.
Inwiefern Bodenbearbeitungsmaßnahmen DOC beeinflusst, ist bislang wenig
untersucht (Kalbitz et al. 2000). Mögliche Auswirkungen sind bedingt
durch eine veränderte Belüftung des Oberbodens. Während durch das Walzen
von Grünland die oberste, aerobe Bodenzone verdichtet und
sauerstoffärmer wird, ist mit lockernder Bodenbearbeitung (Grubbern,
Pflügen usw.) eine verstärkte Belüftung des Bodens verbunden. Gute
Belüftung bei gleichzeitig ausreichender Wasserversorgung könnte die
Mikrobenaktivität im Boden erhöhen und somit zu einer steigenden
DOC-Nachlieferung führen. Für zwei mineralische Standorte
(Locker-Syrosem und Pelosol) haben Don
und Schulze (2008) jedoch gezeigt,
dass nach Bodenbearbeitung (Pflügen) keine erhöhten DOC-Austräge
auftreten, was mit dem recht trockenen und ohnehin gut belüfteten
Oberboden erklärt werden könnte.
4. Fazit
Abiotische Bodenparameter beeinflussen direkt die Vitalität von Bodenmikroben und somit auch Produktion und Verbrauch von DOC. In Laborversuchen konnten diese Zusammenhänge nachgewiesen werden; im Freiland sind die entsprechenden Nachweise allerdings schwieriger, da Wechselwirkungen und weitere Einflussfaktoren eindeutige Wirkungsbeziehungen überlagern. Die mit landwirtschaftlicher Nutzung verbundenen Veränderungen im Stoff- und Wasserhaushalt von Mooren können als Ursachengefüge für erhöhte Konzentrationen und Austräge von DOC angesehen werden. Insgesamt bestehen noch große Unsicherheiten zu den Zusammenhängen zwischen DOC und Landnutzung, weshalb weiterer Forschungsbedarf besteht, um standortangepasste Landnutzungsempfehlungen für hydromorphe Böden aussprechen zu können.
Literatur:
Aravena, R. & Wassenaar, L. I. (1993):
Dissolved organic
carbon and methane in a regional confined aquifer, southern Ontario,
Canada: Carbon isotope evidence for associated subsurface sources. -
App. Geochem. 8.
S.
483–493.
Arvola,
L., Räike, A., Kortelainen, P. & Järvinen, M. (2004): The effect of
climate and landuse on TOC concentrations and loads in Finnish rivers. -
Boreal Environ. Res. 9.
S. 381–387.
Baskaran, S., Bolan, N. S., Rahman,
A. & Tillman, R. W. (1996): Effect of exogenous carbon on the sorption and movement of
atrazine and 2,4-D by soils. - Aust. J. Soil Res.
34.
S. 609–622.
Bengtson, G. & Törneman, N. (2004): Dissolved organic carbon dynamics in the
peat-streamwater interface. - Biogeochem.
70.
S. 93–116.
Billet, M. F., Palmer, S. M., Hope, D., Deacon, C., Storeton-West, R.,
Hargreaves, K. J., Flechard, C. & Fowler, D. (2004):
Linking
land-atmosphere-stream carbon fluxes in a lowland peatland system. -
Glob. - Biogeochem.
Cyc. 18:
GB1024.
Böhm, A. K. (2006):
Hochmoore im Erzgebirge – Untersuchungen zum Zustand und
Stoffaustragsverhalten unterschiedlich degradierter Flächen. - 200 S.;
Dissertation Technische Universität Dresden.
Bragazza, L., Freeman, C., Jones, T., Rydin, H., Limpens, J., Fenner, N.,
Ellis, T., Gerdol, R., Hájek, M., Hájek, T., Iacumin, P., Kutnar, L.,
Tahvanainen, T., Toberman, H. (2006): Atmospheric nitrogen deposition promotes carbon loss from peat
bogs. - Proc. Natl. Acad. Soc. USA
103(51).
S. 19386–19389.
Burford, J. R. & Bremner, J. M. (1975): Relationships between denitrification
capacities of soils and total, waters-soluble and readily decomposable
soil organic matter. - Soil Biol. Biochem.
7.
S. 389–394.
Carroll, P. & Crill, P. (1997): Carbon balance of a temperate poor fen. - Glob. Biogeochem.
Cyc. 11(3).
S. 349–356.
Chapelle, F. H. (2000):
Ground-water microbiology and geochemistry. - 496 S.; New York (Wiley &
Sons).
Chin, Y. P.,Traina, S. J., Swank, C. R. & Backhus, D. (1998): Abundance and
Properties of Dissolved Organic Matter in Pore Waters of a Freshwater
Wetland. - Limnol. Ozeanogr.
43(6).
S. 1287–1296.
Chow, A. T., Tanji, K. K. & Gao, S. (2003): Production of dissolved organic carbon
(DOC) and trihalomethane (THM) precursor from peat soils. - Water
Research 37(18).
S. 4475–4485.
Chow, A. T., Tanji K. K., Gao, S. & Dahlgren, R. A. (2006): Temperature, water
content and wet-dry-cycle effects on DOC production and carbon
mineralization in agricultural peat soils. - Soil Biol. Biochem.
38.
S. 477–488
Christ, M. J. & David, M. B. (1996):
Temperature and moisture effects on the
production of dissolved organic carbon in a Spodosol. - Soil Biol.
Biochem. 28(9).
S.
1191–1199.
Clark, J. M., Ashley, D., Wagner, M., Chapman, p. J., Lane, S. N., Evans,
C. D. & Heathwaite, A. L. (2009):
Increased temperature sensitivity of net DOC
production from ombrotrophic peat due to water table draw-down. - Glob.
Change Biol. 15.
S. 794–807.
Curtin,
D., Campbell, C.A. & Jalil, A. (1998): Effects of acidity on mineralization:
pH-dependence of organic matter mineralization in weakly acidic soils. -
Soil Biol. Biochem. 30(1).
S. 57–64.
Dalva,
M. M. & Moore, T. R. (1991): Sources and sinks of dissolved organic carbon
in a forested swamp catchment.- Biogeochem.
15.
S. 1–19.
Dawson, H. J., Ugolini, F. C., Hurtford, B. F. & Zachara, J. (1978): Role of Soluble
Organics in the Soil Processes of A Podzol, Central Cascades,
Washington. - Soil Sci. 126(5).
S. 290–296.
Dawson, J. J. C., Billet, M. F., Neal, C. & Hill, S. (2002):
A comparison of
particulate, dissolved and gaseous carbon in two contrasting upland
streams in the UK. - J. Hydrol.
257.
S. 26–246.
Dawson, J. J. C., Billet, M. F., Hope, D., Palmer, S. M. & Deacon, C. M.
(2004):
Sources and sinks of aquatic carbon in a peatland stream continuum. -
Biogeochem. 70.
S.
71–92.
Dillon, P. J., Molot, L. A. (1997): Effect of landscape form on export of
dissolved organic carbon, iron, and phosphorus from forested stream
catchments. -Wat. Resour. Res.
33(11).
S. 2591–2600.
Don, A.
&
Schulze, E.-D. (2008): Controls on fluxes and export of
dissolved organic carbon in grasslands with contrasting soil types. –
Biogeochem. 91:117–131.
Driscoll, C. T., Fuller, R. D. & Simone, D. M. (1988): Longitudinal
Variations in Trace Metal Concentrations in a Northern Forested
Ecosystem. - J. Environ. Qual.
17.
S. 101–107.
Driscoll, C. T., Billet, V., Yan, C., Schofield,
C. L., Munson, R. & Holsapple, J. (1995): The role of dissolved organic carbon
in the chemistry and bioavailability of mercury in remote Adirondack
lakes. - Water Air Soil Pollut.
80. S. 499–508.
Evans,
C. D., Chapman, P. J., Clar, J. M., Monteith, D. T. & Cresser, M. S. (2006): Alternative
explanations for rising dissolved organic carbon export from organic
soils. - Glob. Change Biol. 12.
S. 2044–2053.
Evans, C. D.,Goodale, C. L., Caporn,
S. J. M., Dise, N. B., Emmett, B. A., Fernandez, I. J., Field, C. D.,
Findlay, S. E. G., Lovett, G. M., Meesenburg, H., Moldan, F. & Sheppard,
L. C. (2008):
Does
elevated nitrogen deposition or ecosystem recovery from acidification
drive increased dissolved organic carbon loss from upland soil? A review
of evidence from field nitrogen addition experiments. ‑ Biogeochem.
91.
S. 13–35
Falkengren-Grerup, U. & Tyler, G. (1993):
The importance of soil acidity, moisture,
exchangeable cation pools and organic matter solubility to the cationic
composition of beech forest (Fagus
sylvatica L.) soil solution. - Z. Pflanzenernähr. Bodenk.
156(4).
S. 365–370.
Fee, E. J., Hecky, R. E., Kasian, S. E. M. & Cruikshank, D. R. (1996): Effects of Lake
Size, Water Clarity, and Climatic Variability on Mixing Depths in
Canadian Shield Lakes. - Limnol. Oceanogr.
41(5).
S. 912–920.
Fiedler, S., Höll, B. S., Freibauer, A., Stahr, K., Drösler, M.,
Schloter, M., Jungkunst, H.F. (2008):
Particulate organic carbon (POC) in relation to other
pore water carbon fractions in drained and rewetted fens in Southern
Germany. - Biogeosci. 5.
S. 1615–1623.
Freeman, C., Evans, C. D., Monteith, D. T., Reynolds, B. & Fenner, N.
(2001):
Export
of organic carbon from peat soils. - Nature
412.
S. 785.
Fraser, C. J. D.,
Roulet, N. T., Moore, T. R. (2001): -Hydrol. Process. 15.
S. 3151–3166.
Freeman, C.; Fenner, N.;
Ostle, N. J.; Kang, H.; Dowrick, D. J.; Reynolds, B.; Lock, M. A.;
Sleep, D.; Hughes, S.; Hudson, J. (2004):
Export of dissolved organic carbon from peatlands under elevated carbon
dioxide levels. - Nature 430.
S. 195–198.
Frolking, S., Roulet, N. T., Moore, T. R., Lafleur, P. M., Bubier, J.L. &
Crill, P. M. (2002):
Modelling seasonal to annual carbon balance of MerBleue Bog, Ontario,
Canada. - Glob. Biogeochem. Cyc.
16(3): 4.1–4.21.
Glatzel, S.; Kalbitz, K.; Dalva, M. & Moore, T. (2003): Dissolved organic
matter properties and their relationship to carbon dioxide efflux from
restored peat bogs. - Geoderma
113.
S. 397–411.
Gorham, E., Underwood, J. K., Martin, F. B. & Ogden, J. G. (1986): Natural and
anthropogenic causes of lake acidification in Nova Scotia. - Nature
324. S.
451–453.
Grieve, I. & Gilvear, D. (2008):
Effects of wind farm construction on
concentrations and fluxes of dissolved organic carbon and suspended
sediment from peat catchments at Braes of Doune, central Scotland. -
Mires Peat, 4: Art. 3.
Hagedorn, F., Schleppi, P., Waldner, P., Flühler, H. (2000):
Export of dissolved
organic carbon and nitrogen from Gleysol dominated catchments– the
significance of water flow paths. Biogeochem.
50. S.
137–161.
Hay, G. W., James, J. H. & Vanloon, G. W. (1985):
Solubilization Effects of
Simulated Acid Rain on the Organic Matter of Forest Soil; Preliminary
Results. - Soil Sci. 138. S.
422–430.
Haynes, R.J. (2005): Labile organic matter fractions as central components of the
quality of agricultural soils: an overview. - Adv.
Agron.85. S. 221–268.
Helmer, E. H., Urban, N.
R. & Eisenreich, S. J. (1990): Aluminium
chemistry in peatland waters. - Biogeochem.
9.
S. 247–276.
Höll, B. S. (2007):
Die Rolle des Porenraums im Kohlenstoffhaushalt anthropogen
beeinflusster Niedermoore des Donaurieds. - Hohenheimer Bodenkundliche
Hefte 79, Universität
Hohenheim, Stuttgart.
Höll, B. S., Fiedler, S., Jungkunst, H.F., Kalbitz, K., Freibauer, A.,
Drösler, M. & Stahr, K. (2009):
Characteristics of dissolved organic matter following
20 years of peatland restoration. - Sci. Tot. Environ.
408(1).
S. 78–83.
Jòzefaciuk, G., Sokolowska, Z., Hajnos, M., Hoffmann, Ch. & Renger, M.
(1996):
Large effect of leaching
of DOC on water adsorption properties of a sandy soil. - Geoderma
74(1–2).
S. 125–137.
Kaiser, K., Guggenberger, G. & Zech, W. (1996):
Sorption of DOM and DOM
fractions to forest soils.
‑ Geoderma
74(3–4).
S. 281–303.
Kaiser, K. & Zech, W. (1997): Über die
Sorptionseigenschaften von Waldböden bezüglich gelöster organischer
Substanzen. - Z. Pflanzenernähr. Bodenk.
160(2).
S. 295–301.
Kalbitz, K. & Knappe, S.
(1997):
Einfluß der Bodeneigenschaften
auf die Freisetzung der gelösten organischen Substanz (DOM) aus dem
Oberboden. - Z. Pflanzenernähr.
Bodenk.
160. S. 475–483.
Kalbitz, K.
&
Wenrich, R.
(1998): Mobilization of heavy metals and arsenic in polluted wetlands
soils and its dependence on dissolved organic matter. - Sci. total
Environ. 209. S. 27–39.
Kalbitz, K., Geyer, W. & Geyer, S. (1999): Spectroscopic properties of dissolved humic
susbtances – a reflexion on land use history in a fen area. -
Biogeochem. 47. S. 219–238.
Kalbitz, K., Solinger, S., Park, J.-H., Michalzik, B. & Matzner, E.
(2000):
Controls of the Dynamics of Dissolved Organic Matter in Soils: A Review.
- J. Soil Sci. 165(4).
S. 277–304.
Kalbitz, K. & Geyer, S. (2002): Different effects of peat degradation on
dissolved organic carbon and nitrogen. - Org. Geochem.
33.
S. 319–326.
Kalbitz, K., Schmerwitz, J., Schwesig, D. & Matzner, E. (2003): Biodegradation of
soil-derived dissolved organic matter as related to its properties. -
Geoderma 113(3–4.
S. 273–291.
Kieckbusch, J. J. (2003):
Ökohydrologische Untersuchungen zur
Wiedervernässung von Niedermooren am Beispiel der Pohnsdorfer Stauung. -
197 S. Dissertation der Christian-Albrechts-Universität zu Kiel.
Koprivnjak, J.-F. & Moore, T. R. (1992): Sources, sinks and fluxes of dissolved
organic carbon in subartic fen catchment. - Arc. Alp. Res.
24(3).
S. 201–210.
Krasner, S. W. (1999): Chemistry of disinfection by-product formation. In: Singer, P. C.
(Hrsg.): Formation and Control of Disinfection By-Products in Drinking
Water. - 424 S.; Denver, USA (American Water Works Association).
Lundquist, E. J., Jackson, L. E. & Scow, K. M. (1999): Wet–dry cycles affect dissolved
organic carbon in two California agricultural soils. - Soil Biol.
Biochem. 31(7).
S. 1031–1038.
Marschner, B. & Bredow, A. (2002): Temperature effects on release and
ecologically relevant properties of dissolved organic carbon sterilized
and biologically active soil samples. - Soil Biol. Biochem.
34.
S. 459–466.
McKnight, D., Thurmann, E. M., Wershaw, E. L. & Hemond, H. (1985): Biogeochemistry
of Aquatic Humic Substances in Thoreau's Bog, Concord, Massachusetts. -
Ecology 66(4).
S. 1339–1352.
Merckx, R., Brans, K. & Smolders, E. (2001): Decomposition of dissolved organic
carbon after soil drying and rewetting as an indicator of metal toxicity
in soils. - Soil Biol. Biochem.
33(2).
S. 235–240.
Michalzik, B. & Matzner, E. (1999): Dynamics of dissolved organic nitrogen and carbon in a Central
European Norway spruce ecosystem. - Eur. J. Soil Sci.
50(4).
S. 579–590.
Mitch,
W. J., Gosselink, J. G. (2000):
Wetlands. - 920 S.; New York (Wiley and Sons).
Moore,
T. R. (1987):
Patterns of dissolved organic matter in
subarctic peatlands. - Earth Surf. Proc. Land.
12.
S. 387–397.
Moore, T. R. (1989):
Dynamics of dissolved organic carbon in forested and disturbed
catchments, Westland, New Zealand. - 1. Maimai. Wat. Resour. Res.
25.
S. 1321-1330.
Moore,
T. R., de Souza, W. & Koprivnjak, J.-F. (1992): Controls on the Sorption of Dissolved
Organic Carbon by Soils. - Soil Sci.
154(2).
S. 120–129.
Moore, T.R.
(1998): Dissolved Organic Carbon: Sources, Sinks and Fluxes and Role in
the Soil Carbon Cycle. In: Lal, R. (Hrsg.): Soil processes and the
carbon cycle. - 609 S.; Boca Raton – Florida, USA (CRC Press LCC).
Moore, T. R. & Dalva, M. (2001):
Some controls on the release of dissolved
organic carbon by plant tissues and soils. - Soil Sci.
166(1).
S. 38–47.
Nelson,
P. N., Baldock, J. A. & Oades J. M. (1993): Concentration and composition of
dissolved organic carbon in streams in relation to catchment soil
properties. - Biogeochem. 19(1).
S. 27–50.
Palmer, S., Hope, D., Billett, M. F., Dawson, J. J. C. & Bryant, C.
(2001):
Sources of organic and inorganic carbon in a headwater stream: Evidence
from carbon isotope studies. - Biogeochem.
52. S. 321–338.
Sachse, A., Babenzien, D., Ginzel, G., Gelbrecht, J. & Steinberg, C. E.
W.
(2001): Characterization of dissolved organic carbon (DOC) of a
dystrophic lake and an adjacent fen. - Biogeochem.
54. S. 279–296.
Sachse, A., Henrion, R., Gelbrecht & J.,Steinberg, C. E. W. (2005): Classification of
dissolved organic carbon (DOC) in river systems: Influence of catchment
characteristics and autochthonous processes. - Org. Geochemi.
36(6).
S. 923–935.
Schwalm, M.
(2010/2011): unveröffentlichte Messungen.
Scott, M. J., Jones, M. N., Woof, C. & Tipping, E. (1998): Concentrations
and fluxes of dissolved organic carbon in drainage water from an upland
peat system. - Environ. Int.
24(5–6).
S. 537–546.
Szajdak, L., Brandyk, T. & SzatyloŁwicz,
J. (2007): Chemical properties of different peat-moorsh soils from the
Biebrza River Valley. - Agron. Res.
5(2).
S. 165–174.
Strack, M., Waddington, J. M., Bourbonniere, R. A., Buckton, E. L., Shaw,
K., Whittington, P. & Price, J. S. (2008): Effect of water table drawdown on
peatland dissolved organic carbon export and dynamics. - Hydrol. Proc.
22. S. 3373–3385.
Søndergaard, M. &Middelboe, M. (1995): A cross-system
analysis of labile dissolved organic carbon.
‑ Mar.
Ecol. Prog. Ser. 118. S. 283–294.
Tauchnitz, N., Osterloh,
K., Bernsdorf, S., Meissner, R. & Kison, H.-U. (2010): Veränderung der Wasser- und Nährstoffdynamik eines
entwässerten Moores im Nationalpark Harz nach Wiedervernässung.
‑ TELMA
40. S.
229–244; Hannover.
Thurman, E. M. (1985): Classification of dissolved organic carbon. - In: Organic
geochemistry of natural waters. - 496 S.; Dordrecht (Kluwer Academic
Publishers).
Tipping, E.; Woof, C.; Rigg, E.; Harrison, A. F.; Ineson, P.; Taylor, K.;
Benham, D.; Poskitt, J.; Rowland, A. P.; Bol, R.; Harkness, D. D.
(1999):
Climatic influences on the
leaching of dissolved organic matter from upland UK moorland soils,
investigated by a field manipulation experiment. - Environ. Internat.
25(1).
S. 83–95.
Tranvik, L. J. (1998): Degradation of dissolved organic matter in humic waters by
bacteria. - In: Hessen, D. O. & Tranvik, L. J. (Hrsg.): Aquatic humic
substances: ecology and biogeochemistry. - 346 S.; Berlin Heidelberg
(Springer).
Urban, N. R., Bayley, S. E. &Eisenreich, S. J. (1989):
Export of Dissolved
Organic Carbon and AcidityFrom Peatlands. - Water Resour. Res.
25(7).
S. 1619–1628.
Vance, G. F. & David, M. B. (1989):
Effect of Acid Treatment on Dissolved Organic
Carbon Retention by a Spodic Horizon. - Soil Sci. Soc. Am. J.
53. S. 1242–1247.
Worrall, F., Reed, M., Warbuton, J. & Burt, T. (2003): Carbon budget for
a British upland peat catchment. - Sci. Tot. Environ.
312(1–3).
S. 133–146.
Worrall, F., Burt, T. P., Adamson, J. (2008):
Long-term records of dissolved organic carbon
flux from peat-covered catchments: evidence for a drought effect? -
Hydrol.Process. 22. S. 3181–3193.
You,
S.-J., Yin, Y.& Allen, H. E.
(1999): Partitioning of organic
matter in soils: effects of pH and water/soil ratio. - Sci. total
Environ.
227(2–3).
S. 155–160.
Zak,
D. (2001): Steuerungsmechanismen des
Stoffrückhaltes beim Übergang von anaerobem Porenwasser aus dem Moor in
sauerstoffhaltiges Oberflächenwasser unter besonderer Berücksichtigung
des Phosphors. - 95 S.; Diplomarbeit Humboldt-Universität zu Berlin.
Zak, D., Gelbrecht, J. & Steinberg, C. E. W. (2004):
Phosphorus Retention at
the Redox Interface of Peatlands Adjacent to Surface Waters in Northeast
Germany. - Biogeochem. 70(3).
S. 357–368.
Zak, D.
& Gelbrecht, J. (2007):
The mobilisation of phosphorus, organic carbon and
ammonium in the initial stage of fen rewetting (a case study from NE
Germany). - Biogeochem.
85. S.
141–151
Zak,
D. & Gelbrecht, J. (2008):
Phosphormobilisierung in wiedervernässten Niedermooren – Status,
Ursachen und Risiken für angrenzende Gewässer. -
In: Gelbrecht, Zak,
Augustin (Hrsg.): Phosphor- und Kohlenstoffdynamik und
Vegetationsentwicklung in wiedervernässten Mooren des Peenetals in
Mecklenburg-Vorpommern. Berichte des IGB
26.
Zak,
D., Steffenhagen, P. & Gelbrecht, J. (2009): Boden- und Wasserchemische Veränderungen in
degradierten Torfmoosmooren und Möglichkeiten ihrer Renaturierung unter
Naturschutzaspekten – dargestellt am Beispiel Berliner Moore. - TELMA
39.
S. 119–138;
Hannover.
Zauft, M. & Zeitz, J.
(2011):
DOC-Austräge aus wiedervernässten Niedermooren – eine
Fallstudie.
‑TELMA
41 (dieses Heft); Hannover.
Zeitz, J., Zauft, M. & Rosskopf, N. (2008): Use of stratigraphic and pedogenetic
information for the evaluation of carbon turnover in peatlands. - In:
Farrell and Feehan (Hrsg.): Proceedings of 13th International Peat
Congress, Vol. 1.
S. 653-655,
Tullamore.